DISPERSIONES COLOIDALES


Si las macromoléculas en suspensión son polares se forma una dispersión estable, como la
clara de huevo. Si son apolares, como el aceite, la dispersión resultante es inestable y se acaba separando en dos fases:


En la mayonesa tambén se mezclan aceite y agua, formando una suspensión estable. ¿Cómo se consigue esto?
Mezclando con fuerza (con una batidora) con un tercer ingrediente que actúa como emulsionante: la yema del huevo, que contiene lecitina (del griego "Lekitos", yema del huevo), fosfolípido emulsionante o emulgente, que debido a su carácter anfipático, estabiliza las dispersiones inestables que se forman al tratar de mezclar dos líquidos inmiscibles.
Características de los coloides:
1. Efecto Tyndall: los coloides son translúcidos ya que las grandes partículas dispersas refractan la luz. esto sirve para distinguirlas de las disoluciones verdadera, que son transparentes:


Coloide en estado de gel: translúcido. La gelatina se obtiene del colágeno.
2. Alta viscosidad. Ej. la miel.
3. Gran poder de adsorción.
4. El paso de sol a gel es reversible si no llegan a precipitar las macromoléculas. Se realiza por cambios de T o de pH. Si llegan a precipitar, el cambio puede ser irreversible. Investiga si la gelatina es un coloide que ha pasado al estado de gel irreversiblemente o no. Puedes buscar la información en internet o, mejor, experimentarlo en la cocina de tu casa.
5. Las partículas de la fase dispersa, si son sometidos a fuertes campos gravitatorios, como en la
ultracentrifugación, precipitan. Así se puede obtener un sedimentado de ARNr, de proteínas ribosómicas, de subunidades ribosómicas y de ribosomas, diferenciándose por densidad, asignándose un coeficiente de sedimentación
S (Svedberg). P.ej. los ribosomas procarióticos son 70S y los eucarióticos 80S.



6. Las partículas de la fase dispersa se pueden separar en función de su carga eléctrica y masa molecular cuando son sometidas a campos eléctricos. El proceso se llama
electroforesis y puede servir para separar diferentes proteínas de una dispersión.

7. Los coloides pueden ser
suspensiones, si las partículas de la fase dispersa son sólidas, como un engrudo de harina (almidón) en agua:

Si la fase dispersa es líquida, se llaman
emulsiones.
DISPERSIONES MOLECULARES O DISOLUCIONES VERDADERAS
Haz una tabla con, al menos, 6 diferencias, entre las dispersiones coloidales y las moleculares.

Cuando dos sistemas dispersos se ponen en contacto, pueden ocurrir diferentes procesos espontáneos (sin gasto de energía), DEPENDIENDO DE LA PERMEABILIDAD de la membrana que las separa:
 1. DIFUSIÓN
1. DIFUSIÓN

Es un transporte pasivo (sin gasto energético) a favor de gradiente. Así entra el oxígeno en una célula animal y sale de una c. fotosintética. En sentido inverso se mueve el dióxido de carbono.
2. DIÁLISIS


 3. ÓSMOSIS
3. ÓSMOSIS

Este proceso no requiere energía pero el inverso sí (la ósmosis inversa para desalinizar el agua del mar).


 ESTÁNDARES DE EVALUACIÓN
ESTÁNDARES DE EVALUACIÓN
1.1. Describe técnicas instrumentales y métodos físicos y químicos que permiten
el aislamiento de las diferentes moléculas y su contribución al gran avance de
la experimentación biológica (diálisis,
centrifugación y electroforesis).
2.3.
Contrasta los procesos de difusión, ósmosis y diálisis, interpretando su
relación con la concentración salina de las células.
 Linamarina, ejemplo de glucósido cianogénico, como la amigdalina de las almendras amargas, que si es ingerida en grandes cantidades (más de 1,5 kg) puede provocar envenenamiento por cianuro.
Linamarina, ejemplo de glucósido cianogénico, como la amigdalina de las almendras amargas, que si es ingerida en grandes cantidades (más de 1,5 kg) puede provocar envenenamiento por cianuro.



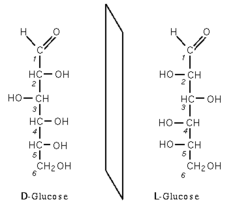
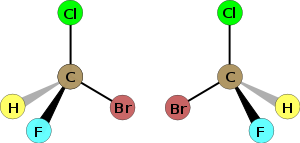 Este C es asimétrico pues está unido a 4 sustituyentes diferentes.
Este C es asimétrico pues está unido a 4 sustituyentes diferentes.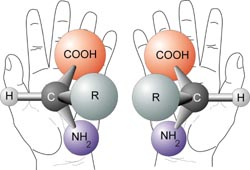 Imágenes especulares de un aa quiral (con C asimétrico). La quiralidad o existencia de isómeros no superponibles es una propiedad muy importante en Bioquímica,p.ej. en la unión deuna enzima con su sustrato. El término "quiral" y "quiralidad" (Chirality) fue creado por Kelvin, haciéndolo derivar de la palabra griega "KIR", que significaba "mano" (de donde también viene la palabra quiromasaje), que es el objeto quiral más familiar.
Imágenes especulares de un aa quiral (con C asimétrico). La quiralidad o existencia de isómeros no superponibles es una propiedad muy importante en Bioquímica,p.ej. en la unión deuna enzima con su sustrato. El término "quiral" y "quiralidad" (Chirality) fue creado por Kelvin, haciéndolo derivar de la palabra griega "KIR", que significaba "mano" (de donde también viene la palabra quiromasaje), que es el objeto quiral más familiar.