a) FILAMENTOSAS
1.1.

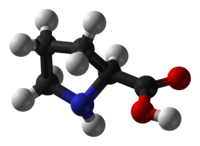 Colágenos: Cuando el colágeno se desnaturaliza por ebullición y se deja enfriar, manteniéndolo en una solución acuosa, se convierte en una sustancia muy conocida, la gelatina. El colágeno es muy rico en Pro y OH-Pro:
Colágenos: Cuando el colágeno se desnaturaliza por ebullición y se deja enfriar, manteniéndolo en una solución acuosa, se convierte en una sustancia muy conocida, la gelatina. El colágeno es muy rico en Pro y OH-Pro:
El proceso de formación de la OH-Pro es el siguiente:
 Esta reacción requiere del coenzima ácido ascórbico (vit C). Por eso, en el escorbuto no se sintetiza suficiente colágeno. La hidroxilación de la Pro y de la Lys (para formar OH-Lys) se realiza en el RER, después de sintetizado el procolageno por losribosomas adosados al RE.
Esta reacción requiere del coenzima ácido ascórbico (vit C). Por eso, en el escorbuto no se sintetiza suficiente colágeno. La hidroxilación de la Pro y de la Lys (para formar OH-Lys) se realiza en el RER, después de sintetizado el procolageno por losribosomas adosados al RE.
El colágeno presenta estructura secundaria (cadena alfa, una hélice más distendida que la alfa-hélice, con 3 aa por vuelta) y, puesto que es una proteína fibrosa, no globular, no presenta estructura terciaria, pero sí cuaternaria, la triple hélice.
1.2. Queratinas
 El pelo está construido por macrofibrillas de queratina empaquetadas por fuera; éstas están formadas por microfibrillas, que se retuercen en un arrollamiento hacia la izquierda. Las interacciones entre las hebras se producen a través de puentes disulfuro. La queratina del pelo presenta alta proporción de alfa queratina, existiendo la posibilidad de transformarla en beta queratina si, por ejemplo, aplicamos calor más humedad. El pelo puede incluso duplicar su longitud. Esto sucede porque se rompen los puentes de hidrógeno de la hélice y las cadenas polipeptídicas adoptan una conformación extendida, en el que la voluminosidad de los grupos laterales -R, hace que la conformación -beta sea inestable, y por lo tanto al poco tiempo seadopte de nuevo la conformación en hélice, con lo que el pelo recupera su longitud original.
El pelo está construido por macrofibrillas de queratina empaquetadas por fuera; éstas están formadas por microfibrillas, que se retuercen en un arrollamiento hacia la izquierda. Las interacciones entre las hebras se producen a través de puentes disulfuro. La queratina del pelo presenta alta proporción de alfa queratina, existiendo la posibilidad de transformarla en beta queratina si, por ejemplo, aplicamos calor más humedad. El pelo puede incluso duplicar su longitud. Esto sucede porque se rompen los puentes de hidrógeno de la hélice y las cadenas polipeptídicas adoptan una conformación extendida, en el que la voluminosidad de los grupos laterales -R, hace que la conformación -beta sea inestable, y por lo tanto al poco tiempo seadopte de nuevo la conformación en hélice, con lo que el pelo recupera su longitud original. 
Las beta-queratinas o fibroínas forman la seda del gusano de seda (insecto) o de la araña (arácnido), ambos artrópodos.

La proteína fibroína consta de capas de láminas beta antiparalelas. Su estructura primaria se compone principalmente de la secuencia de ácido amino recurrente (Gly-Ser-Gly-Ala-Gly-Ala). La proporción grande de glicina y alanina hacen posible el embalaje hermético de las hojas, lo que contribuye a la estructura rígida de seda, que no se puede estirar (resistencia a la tracción). La combinación de rigidez y resistencia hacen que el material sea aplicable en varias áreas, incluyendo la biomedicina y la fabricación textil.


1.3. Elastinas
1.4. Miosinas
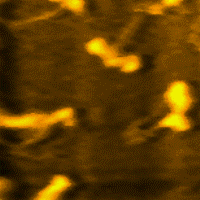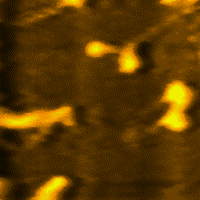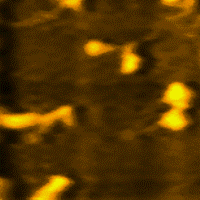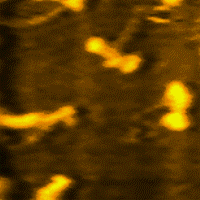 La miosina es una proteína fibrosa, cuyos filamentos tienen una longitud de 1,5 micrometros y un diámetro de 15 nm, que conjuntamente con la actina, permiten principalmente la contracción de los músculos e interviene en la división celular.
La miosina es una proteína fibrosa, cuyos filamentos tienen una longitud de 1,5 micrometros y un diámetro de 15 nm, que conjuntamente con la actina, permiten principalmente la contracción de los músculos e interviene en la división celular.
La miosina es la proteína más abundante del músculo esquelético. Representa entre el 60% y 70% de las proteínas totales.
La actina, también implicada en la contración muscular es, por el contrario, una protína globular.

No hay comentarios:
Publicar un comentario